O Prêmio Nobel de Medicina de 2025 reconheceu Mary Brunkow, Fred Ramsdell e Shimon Sakaguchi pelas descobertas sobre as células T reguladoras (Tregs) e o gene FOXP3, fundamentais para o equilíbrio entre ativação e tolerância do sistema imunológico.1
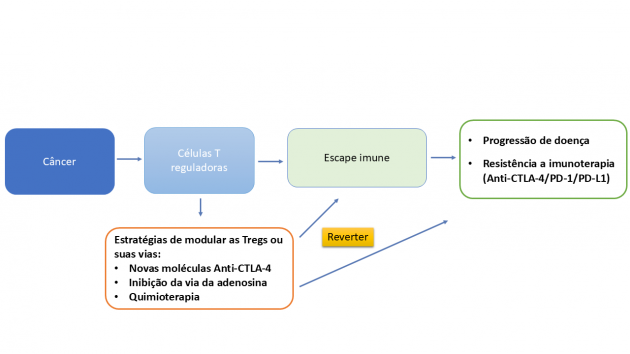
O entendimento dessas descobertas, antes restrito à imunologia básica, redefiniu a compreensão da interface entre o sistema imune e o câncer. A capacidade das Tregs de conter respostas inflamatórias e prevenir autoimunidade, embora essencial à homeostase, revelou-se também uma via de evasão tumoral à vigilância imunológica.
As Tregs configuram um eixo central da imunossupressão tumoral. No microambiente neoplásico, essas células reprimem a atividade de linfócitos T efetores, liberam mediadores imunossupressores como adenosina (via CD39/CD73) e expressam moléculas inibitórias, como CTLA-4 e PD-1, contribuindo para um fenótipo imunológico menos responsivo à imunoterapia.
 A seguir, serão explorados os principais aspectos do papel das Tregs no prognóstico, nos mecanismos de resistência e nas estratégias terapêuticas voltadas à sua modulação.
Tregs e prognóstico do câncer
O papel das Tregs nas diversas fases da carcinogênese tem sido amplamente estudado por refletir sua natureza ambígua, simultaneamente protetora e permissiva.2
Uma metanálise recente de 24 estudos em câncer de pulmão de células não pequenas (CPNPC) mostrou que menores níveis de Tregs correlacionam-se com melhor sobrevida global e livre de recorrência.3 Em câncer de mama receptor hormonal positivo, foi demonstrado que a heterogeneidade funcional das Tregs vai além de sua densidade: uma subpopulação expressando a variante de splicing FOXP3 Exon 2 (FOXP3E2), com maior capacidade imunossupressora, associou-se a pior sobrevida.4 Esses achados reforçam que não apenas a quantidade, mas o perfil molecular das Tregs influencia o desfecho clínico.
O impacto prognóstico, entretanto, varia conforme o tipo tumoral. Em uma metanálise de 17 estudos envolvendo 3.811 pacientes com câncer colorretal, alta densidade de Tregs FOXP3⁺ no estroma e epitélio tumoral correlacionou-se positivamente com a sobrevida global em 1, 3, 5 e 10 anos.5 De modo semelhante, análises histológicas em tumores ressecados mostraram que a relação CD8/FOXP3 intratumoral é marcador independente de sobrevida global (HR=0,43; IC de 95%: 0,19-0,95), indicando que tumores com predomínio de linfócitos citotóxicos e escassez de Tregs apresentam melhor controle imune.6
Tregs e resistência à imunoterapia
Há evidências robustas de que Tregs participam da resistência à imunoterapia. Em carcinoma renal de células claras metastático, maior fração de Tregs PD-1⁺ intratumorais associou-se a piores desfechos com nivolumabe: sobrevida livre de progressão de 3,19 versus 5,78 meses (p=0,021), sobrevida global de 18,1 versus 27,7 meses (p=0,013) e taxa de resposta de 12,5% versus 31,3% (p=0,059), indicando ausência de benefício quando Tregs PD-1⁺ predominam.7
Em câncer gástrico, o bloqueio de PD-1 com nivolumabe pode expandir Tregs PD-1⁺ altamente proliferativas (Ki67⁺) em pacientes com hiperprogressão, além de aumentar a atividade supressora dessas células in vitro e em modelos murinos, sugerindo um mecanismo importante de escape.8
Estudo translacional recente mostrou que Tregs infiltrantes em tumores de pulmão e pele exibiram reprogramação transcricional imunossupressora após o bloqueio de PD-1/PD-L1, com aumento da expressão de CTLA-4, TIGIT, LAG-3 e CD39, correlacionando-se com ausência de resposta clínica. De forma consistente, pacientes não respondedores com câncer de pulmão e mesotelioma apresentaram expansão de Tregs PD-1⁺ Ki-67⁺ no sangue periférico, evidenciando que o bloqueio de PD-1/PD-L1 pode inadvertidamente potencializar a atividade supressora dessas células, contribuindo para resistência adaptativa à imunoterapia.9
Tregs como alvo terapêutico
A compreensão do papel das Tregs estimulou o desenvolvimento de estratégias de modulação seletiva, visando reverter a resistência imunológica e restaurar a atividade antitumoral.
A abordagem mais antiga, o uso de ciclofosfamida em baixa dose (metronômica) em pacientes com tumores avançados demonstrou capacidade de induzir apoptose de Tregs. Em estudos iniciais, o tratamento resultou em diminuição significativa dos Tregs circulantes após quatro semanas, com melhora da proliferação e da citotoxicidade de células efetoras, embora o efeito fosse transitório e heterogêneo entre pacientes. Ensaios posteriores combinaram o fármaco a vacinas tumorais e bloqueio de checkpoints, mas sem impacto consistente em sobrevida global, reforçando que, apesar de acessível e seguro, o efeito imunomodulador da ciclofosfamida permanece limitado fora de protocolos experimentais .10
Nos últimos anos, o foco da imunomodulação se voltou para intervenções capazes de atuar diretamente sobre o microambiente tumoral. Entre essas estratégias, o bloqueio da via da adenosina (CD73/CD39/A2A) desponta como uma das abordagens mais promissoras.
No ensaio COAST (fase 2, n=189), conduzido em pacientes com CPNPC estágio III, a combinação de durvalumabe + oleclumabe (anticorpo anti-CD73) promoveu melhora significativa da sobrevida livre de progressão (HR=0,59; IC de 95%: 0,37-0,93) e taxa de resposta objetiva superior (35% versus 23,9%) em comparação ao durvalumabe isolado, sem aumento de eventos adversos de grau ≥ 3.11
Além dessa via, estratégias avançadas de modulação seletiva de Tregs ganharam destaque na ESMO 2025, reforçando o interesse na depleção intratumoral controlada como um novo eixo da imunoterapia. Nesse contexto, anticorpos anti-CTLA-4 de nova geração, como botensilimabe e HBM4003, demonstram capacidade aprimorada de reduzir Tregs intratumorais e potencializar a ativação de linfócitos efetores. A combinação botensilimabe (anticorpo anti-CTLA-4 Fc-otimizado) e balstilimabe (anticorpo anti-PD-1) foi avaliada em um estudo multicêntrico de fase Ib envolvendo 123 pacientes com câncer colorretal metastático microssatélite estável sem metástases hepáticas ativas. A taxa de resposta objetiva foi de 20%, com 42% dos pacientes vivos em 24 meses e mediana de sobrevida global de 20,9 meses.12
Esses avanços consolidam uma mudança de paradigma na imunoterapia oncológica: o futuro não depende apenas de intensificar a ativação de linfócitos efetores, mas também de modular com precisão o controle imunológico imposto pelas Tregs, direcionando a resposta imune de forma seletiva, eficaz e segura ao microambiente tumoral.
Referências:
A seguir, serão explorados os principais aspectos do papel das Tregs no prognóstico, nos mecanismos de resistência e nas estratégias terapêuticas voltadas à sua modulação.
Tregs e prognóstico do câncer
O papel das Tregs nas diversas fases da carcinogênese tem sido amplamente estudado por refletir sua natureza ambígua, simultaneamente protetora e permissiva.2
Uma metanálise recente de 24 estudos em câncer de pulmão de células não pequenas (CPNPC) mostrou que menores níveis de Tregs correlacionam-se com melhor sobrevida global e livre de recorrência.3 Em câncer de mama receptor hormonal positivo, foi demonstrado que a heterogeneidade funcional das Tregs vai além de sua densidade: uma subpopulação expressando a variante de splicing FOXP3 Exon 2 (FOXP3E2), com maior capacidade imunossupressora, associou-se a pior sobrevida.4 Esses achados reforçam que não apenas a quantidade, mas o perfil molecular das Tregs influencia o desfecho clínico.
O impacto prognóstico, entretanto, varia conforme o tipo tumoral. Em uma metanálise de 17 estudos envolvendo 3.811 pacientes com câncer colorretal, alta densidade de Tregs FOXP3⁺ no estroma e epitélio tumoral correlacionou-se positivamente com a sobrevida global em 1, 3, 5 e 10 anos.5 De modo semelhante, análises histológicas em tumores ressecados mostraram que a relação CD8/FOXP3 intratumoral é marcador independente de sobrevida global (HR=0,43; IC de 95%: 0,19-0,95), indicando que tumores com predomínio de linfócitos citotóxicos e escassez de Tregs apresentam melhor controle imune.6
Tregs e resistência à imunoterapia
Há evidências robustas de que Tregs participam da resistência à imunoterapia. Em carcinoma renal de células claras metastático, maior fração de Tregs PD-1⁺ intratumorais associou-se a piores desfechos com nivolumabe: sobrevida livre de progressão de 3,19 versus 5,78 meses (p=0,021), sobrevida global de 18,1 versus 27,7 meses (p=0,013) e taxa de resposta de 12,5% versus 31,3% (p=0,059), indicando ausência de benefício quando Tregs PD-1⁺ predominam.7
Em câncer gástrico, o bloqueio de PD-1 com nivolumabe pode expandir Tregs PD-1⁺ altamente proliferativas (Ki67⁺) em pacientes com hiperprogressão, além de aumentar a atividade supressora dessas células in vitro e em modelos murinos, sugerindo um mecanismo importante de escape.8
Estudo translacional recente mostrou que Tregs infiltrantes em tumores de pulmão e pele exibiram reprogramação transcricional imunossupressora após o bloqueio de PD-1/PD-L1, com aumento da expressão de CTLA-4, TIGIT, LAG-3 e CD39, correlacionando-se com ausência de resposta clínica. De forma consistente, pacientes não respondedores com câncer de pulmão e mesotelioma apresentaram expansão de Tregs PD-1⁺ Ki-67⁺ no sangue periférico, evidenciando que o bloqueio de PD-1/PD-L1 pode inadvertidamente potencializar a atividade supressora dessas células, contribuindo para resistência adaptativa à imunoterapia.9
Tregs como alvo terapêutico
A compreensão do papel das Tregs estimulou o desenvolvimento de estratégias de modulação seletiva, visando reverter a resistência imunológica e restaurar a atividade antitumoral.
A abordagem mais antiga, o uso de ciclofosfamida em baixa dose (metronômica) em pacientes com tumores avançados demonstrou capacidade de induzir apoptose de Tregs. Em estudos iniciais, o tratamento resultou em diminuição significativa dos Tregs circulantes após quatro semanas, com melhora da proliferação e da citotoxicidade de células efetoras, embora o efeito fosse transitório e heterogêneo entre pacientes. Ensaios posteriores combinaram o fármaco a vacinas tumorais e bloqueio de checkpoints, mas sem impacto consistente em sobrevida global, reforçando que, apesar de acessível e seguro, o efeito imunomodulador da ciclofosfamida permanece limitado fora de protocolos experimentais .10
Nos últimos anos, o foco da imunomodulação se voltou para intervenções capazes de atuar diretamente sobre o microambiente tumoral. Entre essas estratégias, o bloqueio da via da adenosina (CD73/CD39/A2A) desponta como uma das abordagens mais promissoras.
No ensaio COAST (fase 2, n=189), conduzido em pacientes com CPNPC estágio III, a combinação de durvalumabe + oleclumabe (anticorpo anti-CD73) promoveu melhora significativa da sobrevida livre de progressão (HR=0,59; IC de 95%: 0,37-0,93) e taxa de resposta objetiva superior (35% versus 23,9%) em comparação ao durvalumabe isolado, sem aumento de eventos adversos de grau ≥ 3.11
Além dessa via, estratégias avançadas de modulação seletiva de Tregs ganharam destaque na ESMO 2025, reforçando o interesse na depleção intratumoral controlada como um novo eixo da imunoterapia. Nesse contexto, anticorpos anti-CTLA-4 de nova geração, como botensilimabe e HBM4003, demonstram capacidade aprimorada de reduzir Tregs intratumorais e potencializar a ativação de linfócitos efetores. A combinação botensilimabe (anticorpo anti-CTLA-4 Fc-otimizado) e balstilimabe (anticorpo anti-PD-1) foi avaliada em um estudo multicêntrico de fase Ib envolvendo 123 pacientes com câncer colorretal metastático microssatélite estável sem metástases hepáticas ativas. A taxa de resposta objetiva foi de 20%, com 42% dos pacientes vivos em 24 meses e mediana de sobrevida global de 20,9 meses.12
Esses avanços consolidam uma mudança de paradigma na imunoterapia oncológica: o futuro não depende apenas de intensificar a ativação de linfócitos efetores, mas também de modular com precisão o controle imunológico imposto pelas Tregs, direcionando a resposta imune de forma seletiva, eficaz e segura ao microambiente tumoral.
Referências:
 A seguir, serão explorados os principais aspectos do papel das Tregs no prognóstico, nos mecanismos de resistência e nas estratégias terapêuticas voltadas à sua modulação.
Tregs e prognóstico do câncer
O papel das Tregs nas diversas fases da carcinogênese tem sido amplamente estudado por refletir sua natureza ambígua, simultaneamente protetora e permissiva.2
Uma metanálise recente de 24 estudos em câncer de pulmão de células não pequenas (CPNPC) mostrou que menores níveis de Tregs correlacionam-se com melhor sobrevida global e livre de recorrência.3 Em câncer de mama receptor hormonal positivo, foi demonstrado que a heterogeneidade funcional das Tregs vai além de sua densidade: uma subpopulação expressando a variante de splicing FOXP3 Exon 2 (FOXP3E2), com maior capacidade imunossupressora, associou-se a pior sobrevida.4 Esses achados reforçam que não apenas a quantidade, mas o perfil molecular das Tregs influencia o desfecho clínico.
O impacto prognóstico, entretanto, varia conforme o tipo tumoral. Em uma metanálise de 17 estudos envolvendo 3.811 pacientes com câncer colorretal, alta densidade de Tregs FOXP3⁺ no estroma e epitélio tumoral correlacionou-se positivamente com a sobrevida global em 1, 3, 5 e 10 anos.5 De modo semelhante, análises histológicas em tumores ressecados mostraram que a relação CD8/FOXP3 intratumoral é marcador independente de sobrevida global (HR=0,43; IC de 95%: 0,19-0,95), indicando que tumores com predomínio de linfócitos citotóxicos e escassez de Tregs apresentam melhor controle imune.6
Tregs e resistência à imunoterapia
Há evidências robustas de que Tregs participam da resistência à imunoterapia. Em carcinoma renal de células claras metastático, maior fração de Tregs PD-1⁺ intratumorais associou-se a piores desfechos com nivolumabe: sobrevida livre de progressão de 3,19 versus 5,78 meses (p=0,021), sobrevida global de 18,1 versus 27,7 meses (p=0,013) e taxa de resposta de 12,5% versus 31,3% (p=0,059), indicando ausência de benefício quando Tregs PD-1⁺ predominam.7
Em câncer gástrico, o bloqueio de PD-1 com nivolumabe pode expandir Tregs PD-1⁺ altamente proliferativas (Ki67⁺) em pacientes com hiperprogressão, além de aumentar a atividade supressora dessas células in vitro e em modelos murinos, sugerindo um mecanismo importante de escape.8
Estudo translacional recente mostrou que Tregs infiltrantes em tumores de pulmão e pele exibiram reprogramação transcricional imunossupressora após o bloqueio de PD-1/PD-L1, com aumento da expressão de CTLA-4, TIGIT, LAG-3 e CD39, correlacionando-se com ausência de resposta clínica. De forma consistente, pacientes não respondedores com câncer de pulmão e mesotelioma apresentaram expansão de Tregs PD-1⁺ Ki-67⁺ no sangue periférico, evidenciando que o bloqueio de PD-1/PD-L1 pode inadvertidamente potencializar a atividade supressora dessas células, contribuindo para resistência adaptativa à imunoterapia.9
Tregs como alvo terapêutico
A compreensão do papel das Tregs estimulou o desenvolvimento de estratégias de modulação seletiva, visando reverter a resistência imunológica e restaurar a atividade antitumoral.
A abordagem mais antiga, o uso de ciclofosfamida em baixa dose (metronômica) em pacientes com tumores avançados demonstrou capacidade de induzir apoptose de Tregs. Em estudos iniciais, o tratamento resultou em diminuição significativa dos Tregs circulantes após quatro semanas, com melhora da proliferação e da citotoxicidade de células efetoras, embora o efeito fosse transitório e heterogêneo entre pacientes. Ensaios posteriores combinaram o fármaco a vacinas tumorais e bloqueio de checkpoints, mas sem impacto consistente em sobrevida global, reforçando que, apesar de acessível e seguro, o efeito imunomodulador da ciclofosfamida permanece limitado fora de protocolos experimentais .10
Nos últimos anos, o foco da imunomodulação se voltou para intervenções capazes de atuar diretamente sobre o microambiente tumoral. Entre essas estratégias, o bloqueio da via da adenosina (CD73/CD39/A2A) desponta como uma das abordagens mais promissoras.
No ensaio COAST (fase 2, n=189), conduzido em pacientes com CPNPC estágio III, a combinação de durvalumabe + oleclumabe (anticorpo anti-CD73) promoveu melhora significativa da sobrevida livre de progressão (HR=0,59; IC de 95%: 0,37-0,93) e taxa de resposta objetiva superior (35% versus 23,9%) em comparação ao durvalumabe isolado, sem aumento de eventos adversos de grau ≥ 3.11
Além dessa via, estratégias avançadas de modulação seletiva de Tregs ganharam destaque na ESMO 2025, reforçando o interesse na depleção intratumoral controlada como um novo eixo da imunoterapia. Nesse contexto, anticorpos anti-CTLA-4 de nova geração, como botensilimabe e HBM4003, demonstram capacidade aprimorada de reduzir Tregs intratumorais e potencializar a ativação de linfócitos efetores. A combinação botensilimabe (anticorpo anti-CTLA-4 Fc-otimizado) e balstilimabe (anticorpo anti-PD-1) foi avaliada em um estudo multicêntrico de fase Ib envolvendo 123 pacientes com câncer colorretal metastático microssatélite estável sem metástases hepáticas ativas. A taxa de resposta objetiva foi de 20%, com 42% dos pacientes vivos em 24 meses e mediana de sobrevida global de 20,9 meses.12
Esses avanços consolidam uma mudança de paradigma na imunoterapia oncológica: o futuro não depende apenas de intensificar a ativação de linfócitos efetores, mas também de modular com precisão o controle imunológico imposto pelas Tregs, direcionando a resposta imune de forma seletiva, eficaz e segura ao microambiente tumoral.
Referências:
A seguir, serão explorados os principais aspectos do papel das Tregs no prognóstico, nos mecanismos de resistência e nas estratégias terapêuticas voltadas à sua modulação.
Tregs e prognóstico do câncer
O papel das Tregs nas diversas fases da carcinogênese tem sido amplamente estudado por refletir sua natureza ambígua, simultaneamente protetora e permissiva.2
Uma metanálise recente de 24 estudos em câncer de pulmão de células não pequenas (CPNPC) mostrou que menores níveis de Tregs correlacionam-se com melhor sobrevida global e livre de recorrência.3 Em câncer de mama receptor hormonal positivo, foi demonstrado que a heterogeneidade funcional das Tregs vai além de sua densidade: uma subpopulação expressando a variante de splicing FOXP3 Exon 2 (FOXP3E2), com maior capacidade imunossupressora, associou-se a pior sobrevida.4 Esses achados reforçam que não apenas a quantidade, mas o perfil molecular das Tregs influencia o desfecho clínico.
O impacto prognóstico, entretanto, varia conforme o tipo tumoral. Em uma metanálise de 17 estudos envolvendo 3.811 pacientes com câncer colorretal, alta densidade de Tregs FOXP3⁺ no estroma e epitélio tumoral correlacionou-se positivamente com a sobrevida global em 1, 3, 5 e 10 anos.5 De modo semelhante, análises histológicas em tumores ressecados mostraram que a relação CD8/FOXP3 intratumoral é marcador independente de sobrevida global (HR=0,43; IC de 95%: 0,19-0,95), indicando que tumores com predomínio de linfócitos citotóxicos e escassez de Tregs apresentam melhor controle imune.6
Tregs e resistência à imunoterapia
Há evidências robustas de que Tregs participam da resistência à imunoterapia. Em carcinoma renal de células claras metastático, maior fração de Tregs PD-1⁺ intratumorais associou-se a piores desfechos com nivolumabe: sobrevida livre de progressão de 3,19 versus 5,78 meses (p=0,021), sobrevida global de 18,1 versus 27,7 meses (p=0,013) e taxa de resposta de 12,5% versus 31,3% (p=0,059), indicando ausência de benefício quando Tregs PD-1⁺ predominam.7
Em câncer gástrico, o bloqueio de PD-1 com nivolumabe pode expandir Tregs PD-1⁺ altamente proliferativas (Ki67⁺) em pacientes com hiperprogressão, além de aumentar a atividade supressora dessas células in vitro e em modelos murinos, sugerindo um mecanismo importante de escape.8
Estudo translacional recente mostrou que Tregs infiltrantes em tumores de pulmão e pele exibiram reprogramação transcricional imunossupressora após o bloqueio de PD-1/PD-L1, com aumento da expressão de CTLA-4, TIGIT, LAG-3 e CD39, correlacionando-se com ausência de resposta clínica. De forma consistente, pacientes não respondedores com câncer de pulmão e mesotelioma apresentaram expansão de Tregs PD-1⁺ Ki-67⁺ no sangue periférico, evidenciando que o bloqueio de PD-1/PD-L1 pode inadvertidamente potencializar a atividade supressora dessas células, contribuindo para resistência adaptativa à imunoterapia.9
Tregs como alvo terapêutico
A compreensão do papel das Tregs estimulou o desenvolvimento de estratégias de modulação seletiva, visando reverter a resistência imunológica e restaurar a atividade antitumoral.
A abordagem mais antiga, o uso de ciclofosfamida em baixa dose (metronômica) em pacientes com tumores avançados demonstrou capacidade de induzir apoptose de Tregs. Em estudos iniciais, o tratamento resultou em diminuição significativa dos Tregs circulantes após quatro semanas, com melhora da proliferação e da citotoxicidade de células efetoras, embora o efeito fosse transitório e heterogêneo entre pacientes. Ensaios posteriores combinaram o fármaco a vacinas tumorais e bloqueio de checkpoints, mas sem impacto consistente em sobrevida global, reforçando que, apesar de acessível e seguro, o efeito imunomodulador da ciclofosfamida permanece limitado fora de protocolos experimentais .10
Nos últimos anos, o foco da imunomodulação se voltou para intervenções capazes de atuar diretamente sobre o microambiente tumoral. Entre essas estratégias, o bloqueio da via da adenosina (CD73/CD39/A2A) desponta como uma das abordagens mais promissoras.
No ensaio COAST (fase 2, n=189), conduzido em pacientes com CPNPC estágio III, a combinação de durvalumabe + oleclumabe (anticorpo anti-CD73) promoveu melhora significativa da sobrevida livre de progressão (HR=0,59; IC de 95%: 0,37-0,93) e taxa de resposta objetiva superior (35% versus 23,9%) em comparação ao durvalumabe isolado, sem aumento de eventos adversos de grau ≥ 3.11
Além dessa via, estratégias avançadas de modulação seletiva de Tregs ganharam destaque na ESMO 2025, reforçando o interesse na depleção intratumoral controlada como um novo eixo da imunoterapia. Nesse contexto, anticorpos anti-CTLA-4 de nova geração, como botensilimabe e HBM4003, demonstram capacidade aprimorada de reduzir Tregs intratumorais e potencializar a ativação de linfócitos efetores. A combinação botensilimabe (anticorpo anti-CTLA-4 Fc-otimizado) e balstilimabe (anticorpo anti-PD-1) foi avaliada em um estudo multicêntrico de fase Ib envolvendo 123 pacientes com câncer colorretal metastático microssatélite estável sem metástases hepáticas ativas. A taxa de resposta objetiva foi de 20%, com 42% dos pacientes vivos em 24 meses e mediana de sobrevida global de 20,9 meses.12
Esses avanços consolidam uma mudança de paradigma na imunoterapia oncológica: o futuro não depende apenas de intensificar a ativação de linfócitos efetores, mas também de modular com precisão o controle imunológico imposto pelas Tregs, direcionando a resposta imune de forma seletiva, eficaz e segura ao microambiente tumoral.
Referências:
- The Nobel Prize in Physiology or Medicine 2025. 6 Oct 2025. Disponível em: https://www.nobelprize.org/prizes/medicine/2025/press-release/
- Leite CA, et al. J Immunother Cancer. 2020;8(1):e000129.
- Khambholja K, et al. Syst Rev. 2024;13(1):233.
- Fusco C, et al. Sci Adv. 2025;11(3):eadr7934.
- Hu G, et al. Oncotarget. 2017;8(43):75361-75371.
- Salama P, et al. J Clin Oncol. 2009;27(2):186-92.
- Denize T, et al. Clin Cancer Res. 2024;30(4):803-813.
- Kamada T, et al. Proc Natl Acad Sci U S A. 2019;116(20):9999-10008.
- van Gulijk M, et al. Sci Immunol. 2023;8(83):eabn6173.
- Ghiringhelli F, et al. Cancer Immunol Immunother. 2007;56(5):641-8.
- Aggarwal C, et al. JAMA Netw Open. 2025;8(7):e2518440.
- Schlechter BL, et al. Ann Oncol. 2025; 36(Suppl 7): S7–S8.
Você também pode gostar
[Notícia] Bloqueio da via RAS no câncer de pâncreas: avanços terapêuticos e perspectivas
24 de fevereiro de 2026/
[Notícia] Microbiota intratumoral e resistência à imunoterapia
27 de janeiro de 2026/
Últimas notícias
Consultas públicas abertas para incorporação de novos tratamentos oncológicos na ANS
24 de fevereiro de 2026
/2 min. de leitura
Bloqueio da via RAS no câncer de pâncreas: avanços terapêuticos e perspectivas
24 de fevereiro de 2026
/3 min. de leitura
EVENTO | 9º Simpósio Internacional de Onco-Hematologia - SINTOMA
12 de fevereiro de 2026
/1 min. de leitura
Entre em contato
Para enviar sugestões, dúvidas ou solicitar informações, entre em contato conosco no e-mail:
contato@mocbrasil.com
contato@mocbrasil.com
Sitemap
Livros
Atenção: O conteúdo deste site destina-se exclusivamente a profissionais de saúde. Nunca tome medicamentos tarjados por conta própria; siga sempre as orientações de seu médico. Os autores e editores desta obra fizeram todo esforço para assegurar que as doses e as indicações dos fármacos, bem como dos procedimentos apresentados no texto, estivessem de acordo com os padrões vigentes à época da publicação. Em virtude dos constantes avanços da Medicina e de possíveis modificações regulamentares referentes aos fármacos e procedimentos apresentados, recomendamos que o usuário consulte sempre outras fontes fidedignas, de modo a se certificar de que as informações contidas neste site estão corretas. Isso é particularmente importante no caso de fármacos ou procedimentos novos ou pouco usados. Este site, para uso exclusivo por profissionais de saúde, é editado com objetivos educacionais, estando em conformidade com a resolução no. 097/2001 do Conselho Regional de Medicina do Estado de São Paulo. Responsável técnico: Dr. Antonio Carlos Buzaid, CRM-SP 45405. Nenhuma parte pode ser reproduzida ou transmitida sem a autorização dos autores. O conteúdo deste site é produzido de forma independente e autônoma, sem qualquer interferência das empresas/instituições apoiadoras ou patrocinadoras e sem que haja qualquer obrigação por parte de seus profissionais em relação à recomendação ou prescrição dos produtos/serviços eventualmente comercializados por quaisquer dessas empresas/instituições Copyright © 2026 Antonio Carlos Buzaid. Desenvolvimento: DENDRIX CNPJ 05.371.865/0001-88


